天一大联考 2022-2023学年高三年级上学期期中考试理科数学试题答案
天一大联考 2022-2023学年高三年级上学期期中考试理科数学试题答案,九师联盟答案网已经编辑汇总了天一大联考 2022-2023学年高三年级上学期期中考试理科数学试题答案的各科答案和试卷,更多九师联盟答案请关注九师联盟答案网。




4.(34分)I.(1)O>C>Si(2分)>(2分)(2)ls22s22p3s23p3d04s24p2(或[Ar]3d4s24p2)(3分)SiO2(3分)二者均为原子晶体,Ge原子半径大于Si,Si一O键长小于Ge一O键长,SiO2键能更大,熔点更高(4分)(3)sp(2分)热水破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大(4分)Ⅱ.(4)共价(3分)(5)分子(2分)(6)Al2CL(3分)共价键(3分)(7)B(3分)【解析】I.(1)非金属性越强,电负性越大,C、O、Si三种元素电负性由大到小的顺序为O>C>S;同主族元素从上到下,半径增大,第一电离能依次减小,第一电离能:I1(Si)>I1(Ge).(2)基态G心原子核外电子排布式为1s22s22p°3s23p3di4s24p2或[Ar]3d4s24p2;二者均为原子晶体,Ge原子半径大于Si,Si一O键长小于Ge一O键长,SiO2键能更大,熔点更高。(3)根据硼酸晶体的片层结构图,硼原子形成3个σ键,无孤电子对,硼的杂化方式为sp;热水破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大。Ⅱ.(4)由题给数据在2.02×105Pa时氯化铝的熔点190℃,且在180℃时即开始升华可知,氯化铝的熔沸点较低,不可能是离子化合物,只能是共价化合物。(5)离子化合物熔融态,能电离出离子,熔融氯化铝不导电,所以氯化铝是共价化合物。(6)铝的蒸汽密度折算到标准状况下为11.92g/L,P,氯化铝的摩尔质量=1.92gL1×22.4L·mol1≈267g·mol-1,所以氯化铝的化学式为Al2Cl6,分子晶体中分子之间靠分子间作用力结合在一起,在氯化铝晶体中,微粒间的作用力为分子间作用力,但微粒内以共价键相互结合。(7)共价键以共用电子对成键,分子中原子间通过共用电子对所形成的相互作用,叫共价键,离子键以离子之间的作用力成键,两者属于并列关系,不可以相互转化,A项错误;氯为活泼非金属,铝为活泼金属,但氯化铝是共价化合物,故B项正确:氯化铝的分子式为Al2Cl,是二聚体,C项错误;氯化铝是共价化合物,金属与非金属元素的原子之间也能形成共价键,D项错误。


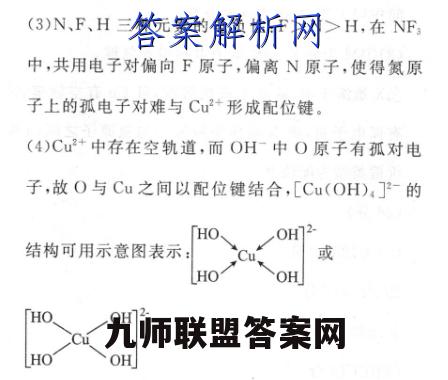
3.(20分)(1)29(1分)3d°4s'(1分)(2)①sp3(1分)②正四面体形(2分)CCL4(2分)③O>S>H(2分)④电子从能量较高的激发态跃迁到能量较低的激发态乃至基态时,将以光的形式释放能量(3分)⑤ac(2分)(3)N、F、H三种元素的电负性:F>N>H,在NF中,共用电子对偏向F原子,偏离N原子,使得氮原子上的孤电子对难与Cu2+形成配位键(3分)HO0H72(4(或)(3分)HOOH【解析】(1)Cu元素为29号元素,原子核外有29个电子,核外电子有29种运动状态;核外电子排布式为1s22s22p3s23p3d4s,则价电子排布式为3d104s。(2)①H0分子中0原子价层电子对数=2+6-1×22一=4,采用sp杂化。②S0中S原子价层电子对数=4+6+24X2=24,硫原子采取sp杂化,不含孤电子对,其立体构型是正四面体;原子个数相等且价电子数相等的微粒为等电子体,与SO互为等电子体的分子为CCl4。③元素的非金属性越强,电负性越大,故电负性:O>S>H④电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量,所以很多金属焰色反应呈现一定的颜色。⑤[Cu(H2O):]+中铜离子与O原子之间形成配位键,水分子中O原子与H原子之间形成极性键。(3)N、F、H三种元素的电负性:F>N>H,在NF中,共用电子对偏向F原子,偏离N原子,使得氮原子上的孤电子对难与Cu2+形成配位键。(4)Cu2+中存在空轨道,而OH-中O原子有孤对电子,故O与Cu之间以配位键结合,[Cu(OH),]-的OH结构可用示意图表示:或HOHOOH
![[淄博一模]山东省淄博市2022-2023学年高三模拟考试政治答案](http://www.jiushilianmeng.com/zb_users/upload/water/2023-02-27/63fc902124c10.jpeg)



![[淄博一模]山东省淄博市2022-2023学年高三模拟考试化学答案](http://www.jiushilianmeng.com/zb_users/upload/water/2023-02-27/63fc8cc719690.jpeg)
![[淄博一模]山东省淄博市2022-2023学年高三模拟考试化学试题答案](http://www.jiushilianmeng.com/zb_users/upload/water/2023-02-27/63fc8cc9e374b.jpeg)