巴蜀中学2023届高考适应性月考卷(四)4数学试题答案
巴蜀中学2023届高考适应性月考卷(四)4数学试题答案,九师联盟答案网已经编辑汇总了巴蜀中学2023届高考适应性月考卷(四)4数学试题答案的各科答案和试卷,更多九师联盟答案请关注九师联盟答案网。



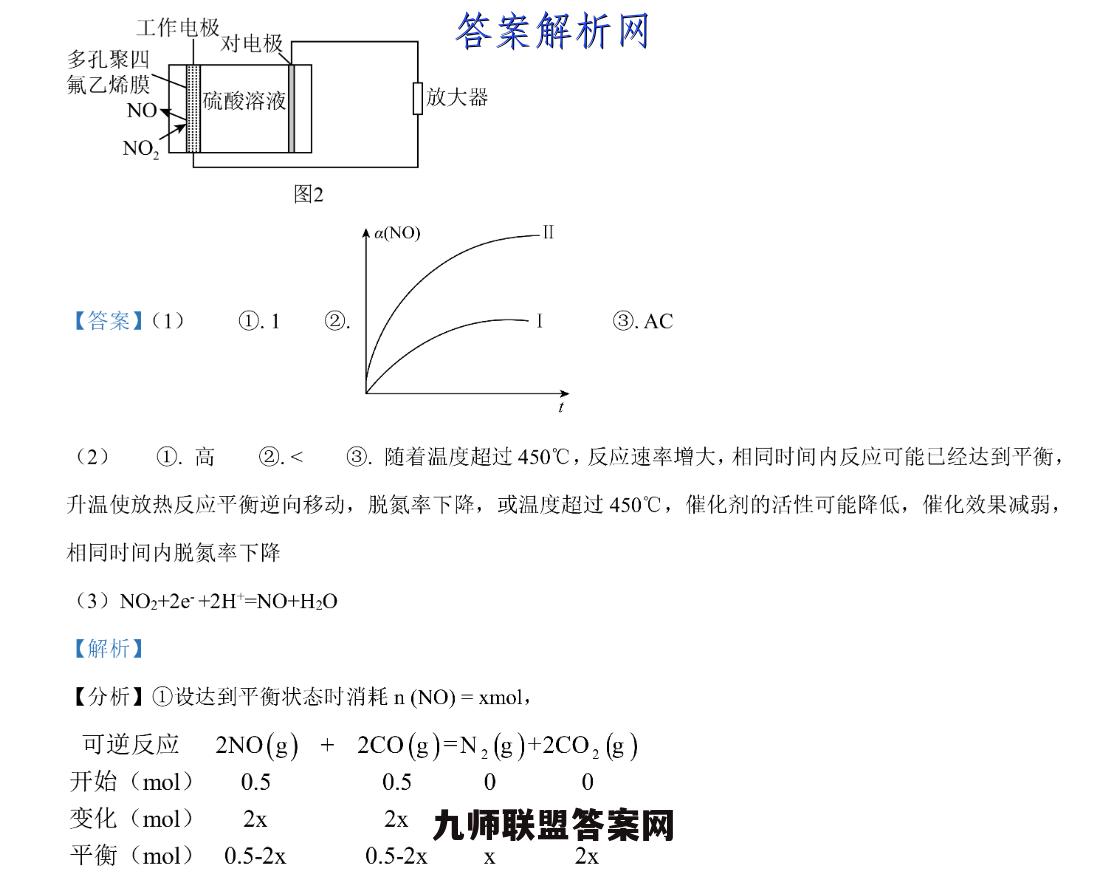



28.研究有害气体的脱硝(除NOx)技术有积极的环保意义。汽车尾气是城市空气污染源之一,其中主要污染物有NO和C0,一定条件下可发生反应:2NO(g)+2CO(g)≥N(g)+2CO,(g)△H<0。(1)T℃时,0.5molN0和0.5molC0在容积为500mL的恒温密闭容器中发生反应,达到平衡状态时,体系压强与初始压强之比为7:8。①T℃时,该反应平衡常数K。=②NO转化率随时间变化曲线I如图所示,若起始投料为0.5 nol NO和1.0 mol CO,请在图中画出NO转化率随时间变化的曲线Ⅱa(NO)③下列说法正确的是A.该反应正反应的活化能小于逆反应的活化能B.使用合适的催化剂可以提高NO的平衡转化率C.平衡状态下,若充入N2则达到新平衡时,正、逆反应速率都增大D.平衡状态下,若保持温度不变,将容器体积增加一倍,则平衡逆向移动,反应物浓度增大(2)催化剂性能决定了尾气处理效果。将NO和CO以一定的流速通过两种不同的催化剂1、)进行反应,测量逸出气体中O含量,可测算尾气脱氮率。相同时间内,脱氮率随温度变化曲线如图1所示。个脱氮率%40302010100200300400500温度℃图1①对于放热反应,平衡体系温度越低,平衡脱氮率越(填“高”或“低)。曲线上a点的脱氮率(填“<”或“=对应温度下的平衡脱氮率。②催化剂Ⅱ条件下,450℃后,脱氮率随温度升高而下降的原因可能是(3)环境监察局常用“定电位NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理图2所示,写出“工作电极”上发生的电极反应式工作电极对电极多孔聚四氟乙烯膜NO硫酸溶液放大器NO,图2a(NO)I【答案】(1)①.1②.③.AC(2)①.高②.<③.随着温度超过450℃,反应速率增大,相同时间内反应可能已经达到平衡,升温使放热反应平衡逆向移动,脱氮率下降,或温度超过450℃,催化剂的活性可能降低,催化效果减弱,相同时间内脱氮率下降(3)NO2+2e+2H+=NO+H2O【解析】【分析】①设达到平衡状态时消耗n(NO)=xmol,可逆反应2NO(g)+2C0(g)=N2(g)+2C02(g)开始(mol)0.50.500变化(mol)2x2xX2x平衡(mol)0.5-2x0.5-2xX2x变化(mol)2x2xX2x平衡(mol)0.5-2x0.5-2xX2x恒温恒容条件下,气体压强之比等于气体物质的量之比,体系压强与初始压强之比为7:8,则(0.5-2x+0.5-2x+x+2x)mol;(0.5+0.5)mol=7:8,x=0.125,平衡时c(N0)=n(0.5-0.125×2)mol0.5mo1/L、c0N2)=0.125mol10.25 mol/L,c(C02)=0.125×2mo=0.5mol/L,T℃V0.5L0.5L0.5L时,该反应平衡常数K=c(N2)xc2(CO2)c2(NO)xc2(CO)②增大CO浓度平衡正向移动导致NO转化率增大且反应速率加快,反应达到平衡时间缩短,平衡时NO转化率大于曲线I的平衡转化率:③A.该反应正反应的活化能小于逆反应的活化能:B.使用合适的催化剂可以提高NO的平衡转化率C.平衡状态下,若充入N2,则达到新平衡时,正、逆反应速率都增大;D.平衡状态下,若保持温度不变,将容器体积增加一倍,则平衡逆向移动,反应物浓度增大:(2)①对于放热反应,平衡体系温度趣低,平衡正向移动:催化剂【条件下,450℃时脱氮率可以达到40%以上.,温度越低,平衡向吸热方向移动:②催化剂1条件下,450℃后,反应速率增大,升高温度平衡逆向移动导致脱氮率下降,或者超过450℃时催化剂效果减弱:(3)工作电极通入NO2生成NO,说明O2被还原,为原电池正极,则“对电极”是负极,原电池工作时,阳离子向正极移动,阴离子向,负极移动,以此来解析:【小问1详解】①设达到平衡状态时消耗n(NO)=xmol,可逆反应2NO(g)+2C0(g)=N,(g)+2CO2(g)开始(mol)0.50.500变化(mo1)2x2xX2x平衡(mol)0.5-2x0.5-2xX2x恒温恒容条件下,气体压强之比等于气体物质的量之比,体系压强与初始压强之比为7:8,则(0.5-2x+0.5-2x+x+2x)mol:(0.5+0.5)mol=7;8,x=0.125,平衡时cN0)=n(0.5-0.125×2)mol0.125mol0.125×2mol-0.5molL,T℃0.5L0.5mol1Lc2)0.5L0.25molL,c(C0)-0.5Lc(N2)×c2(C02)0.25×(0.5)2时,该反应平衡常数Kc=c2(N0)×c2(C0)(0.5)2×(0.5)2②增大CO浓度平衡正向移动导致NO转化率增大且反应速率加快,反应达到平衡时间缩短,平衡时NO转本NO)化率大于曲线1的平衡转化率,其图像为:③A.该反应为放热反应,则反应物总能量大于生成物总能量,所以正反应的活化能小于逆反应的活化能,A正确:B.催化剂只改变化学反应速率不影响平衡移动,所以加入催化剂转化率不变,B错误:C.平衡状态下,若充入N2则达到新平衡时,反应物和生成物浓度都大于原来平衡状态,物质浓度越大反应速率越快,所以正、逆反应速率都增大,C正确:D.平衡状态下,若保持温度不变,将容器体积增加一倍,相当于减小压强,则平衡逆向移动,但反应物浓度减小而不是增人,D错误:故选AC。【小问2详解】①对于放热反应,平衡体系温度越低,平衡正向移动,所以平衡脱氮率越高:催化剂1条件下,450℃时脱氮率可以达到40%以上,温度越低,平衡向吸热方向移动,向逆反应方向移动,则温度越低,平衡脱氮率越高,则a点脱氮率小于对应温度下的平衡脱氮率:②催化剂1条件下,450℃后,反应速盗增大,相问时间内反应可能已经达到平衡,升温使放热反应平衡逆向移动,脱氮率下降或超过450℃时催化剂的活性可能降低,催化效果减弱,相同时间内脱氮率下降:【小问3详解】工作电极通入NO2生成NO,为原电池正极,电极反应式为:NO2+2e+2H=NO+HO:



27.某同学用固体X(四种元素组成的纯净物)进行了如下实验:浓硫酸混合气体甲气体乙酸化硝酸银溶液白色沉淀7.3g28.7gX隔绝空气加热25.1g①红棕色固体稀盐酸16.0g溶液丙(黄色)请回答:(1)混合气体甲的化学成分为(2)步骤①的化学方程式是(3)已知往溶液丙中通入二氧化疏气体黄色会褪去,写出该反应的离子方程式【答案】(1)HC1、H2O隔绝空气加强热(2)2Fe(OH)2C1Fe2O3+2HC1↑+H2O↑(3)S02+2H20+2Fe3t=2Fe2+S0+4H【解析】【分析】7.3g气体乙与酸化硝酸银溶液反应生成28.7g白色沉淀,可推知乙为HC1;红棕色固体溶于稀盐【解析】【分析】7.3g气体乙与酸化硝酸银溶液反应生成28.7g白色沉淀,可推知乙为HC1;红棕色固体溶于稀盐酸得到黄色溶液丙,可推知红棕色固体为Fe,且n(Fe2O3)=0.1mol:又X是由四种前四周期元素组成的纯净物,隔绝空气加热得到混合气体甲,混合气体甲经浓H2SO4处理后得到气体乙(HC),所以X中含有的元素为Fe、Cl、O、H,且25.1gX分解生成16.0gFe203、7.3gHCl,1.8gH20,故n(Fe):n(Cl):n(H):n(O)-0.2mol:0.2mol:0.4mol0.4mol,即X的化学式为Fe(OH)2Cl或FeCl3·2Fe(OH)3,据此分析解题。【小问1详解】根据分析可知混合气体甲的化学成分为HC1、H2O;【小问2详解】X分解生成16.0gFe203、7.3gHCl,1.8gH20,步骤①的化学方程式是隔绝空气加强热2Fe(OH)2C1Fe2O3+2HC1↑+H2O↑;【小问3详解】往溶液丙中通入二氧化硫气体黄色会褪去,说明三价铁离子被还原,该反应的离子方程式:SO2+2H2O+2F3+=2Fe2+S04+4H。
![[淄博一模]山东省淄博市2022-2023学年高三模拟考试政治答案](http://www.jiushilianmeng.com/zb_users/upload/water/2023-02-27/63fc902124c10.jpeg)



![[淄博一模]山东省淄博市2022-2023学年高三模拟考试化学答案](http://www.jiushilianmeng.com/zb_users/upload/water/2023-02-27/63fc8cc719690.jpeg)
![[淄博一模]山东省淄博市2022-2023学年高三模拟考试化学试题答案](http://www.jiushilianmeng.com/zb_users/upload/water/2023-02-27/63fc8cc9e374b.jpeg)